Primary Cnc Lymphoma
خلاصه مقاله
بیماری Primary central nervous system lymphoma (PCNSL) یک لنفوم غیرهوچکین خارج از گرههای لنفاوی (extranodal) است. این بیماری بر مغز، ستون فقرات، مایع مغزی نخاعی (CSF) و فضای vitreoretinal تأثیر میگذارد. تظاهرات بالینی میتواند بسیار متفاوت باشد. تظاهرات بالینی اولیه آنها محدود به ناهنجاریهای بینایی ظریف (subtle visual abnormalities) ، اغلب برای تشخیص نیاز به بررسی با slit lamp دارند. اکثر بیماران مبتلا به PCNSL با درگیری چشمی هیچ علامت بینایی ندارند. بیماران با تظاهرات بالینی باید بلافاصله تحت تصویربرداری مغزی MRI با و بدون کنتراست قرار گیرند. در بیمارانی که قادر به تحمل اسکن MRI نیستند، یک CT با و بدون ماده حاجب انجام شود. برای ایجاد تشخیص قطعی نیاز به بیوپسی از مغز دارد، اما معاینه CSF یا vitrectomy ممکن است تشخیصی باشد. در بیماران با درگیری leptomeningeal انجام staging کامل، lumbar puncture مورد نیاز است. CSF باید از نظر basic cell count with differential، سطح گلوکز، سطح پروتئین، سیتولوژی و فلوسیتومتری ارزیابی شود. درمان PCNSL باید به محض تایید تشخیص شروع شود. درمان این بیماری معمولاً در 2 مرحله انجام می شود: القاء (induction) بصورت شیمی درمانی مبتنی بر MTX استاندارد و تثبیت (consolidation) بصورت شیمی درمانی myeloablative همراه با autologous stem cell transplant (ASCT) تا شیمی درمانی nonmyeloablative با دوز بالا، پرتو درمانی، نگهداری پزشکی (medical maintenance) یا حتی observation را شامل می شوند.
معرفی
بیماری Primary central nervous system lymphoma (PCNSL) یک لنفوم غیرهوچکین خارج از گرههای لنفاوی (extranodal) است. این بیماری بر مغز، ستون فقرات، مایع مغزی نخاعی (CSF) و فضای vitreoretinal تأثیر میگذارد. PCNSL یک سرطان نادر با بروز سالانه 0.4 در 100000 نفر است، اما بروز آن با افزایش سن به 4 در هر 100000 در افراد بالای 70 سال افزایش مییابد. PCNSL تا 6 درصد از تمام لنفومهای extranodal و همچنین 4 درصد از تومورهای بدخیم مغزی تازه تشخیص داده شده را تشکیل میدهد. PCNSL میتواند در هر سنی ایجاد شود (0.4٪ در بیماران کمتر از 9 سال، 1.5٪ در بیماران کمتر از 19 سال رخ میدهد)، اما میانگین سنی آن 56 تا 61 سال است. بیماران با سیستم ایمنی سرکوب شده، مانند مبتلایان به HIV/AIDS یا بیماران پیوندی، در معرض افزایش خطر PCNSL مرتبط با ویروس Epstein-Barr virus هستند.
علائم بالینی
تشخیص PCNSL به سطح بالایی از شک بالینی نیاز دارد زیرا تظاهرات بالینی میتواند بسیار متفاوت باشد. تنها بخشی از بیماران مبتلا به PCNSL (50 تا 70 درصد) با نقایص focal neurologic مراجعه میکنند. تقریباً به طور معمول، بیماران مبتلا به PCNSL (40٪ تا 50٪) ممکن است تغییرات شناختی یا رفتاری غیراختصاصی را طی چند هفته تا چند ماه ایجاد کنند. علائم افزایش فشار داخل جمجمهای مانند سردرد، استفراغ یا حالت تهوع نیز ممکن است (33%) دیده شود، اما همیشه به راحتی به عنوان علائم نورولوژیک شناسایی نمیشوند. بیماران ممکن است لنفوم ایزوله شده در فضای شبکیهای داشته باشند. در نتیجه، تظاهرات بالینی اولیه آنها ممکن است محدود به ناهنجاریهای بینایی ظریف (subtle visual abnormalities) ، مانند تاری، کاهش حدت، یا floaters باشد. هنگامی که چشم تنها محل بیماری است، بیماران مبتلا به primary intraocular lymphoma تشخیص داده میشوند. علائم primary intraocular lymphoma میتواند بسیار ضعیف باشد و ممکن است سالها قبل از درگیری سایر بخش های سیستم عصبی مرکزی (CNS) دیده شود. ناهنجاری های چشمی اغلب برای تشخیص نیاز به بررسی با slit lamp دارند. حتی در صورت مشاهده، این تغییرات را میتوان به اشتباه تشخیص داد زیرا اغلب شبیه uveitis هستند. اکثر بیماران مبتلا به PCNSL با درگیری چشمی هیچ علامت بینایی ندارندB symptoms، در PCNSL نادر است.
تشخیص
بیمارانی که دارای علائمی هستند که در بالا توضیح داده شد باید بلافاصله تحت تصویربرداری مغزی قرار گیرند. روش تصویربرداری ترجیحی، MRI با و بدون کنتراست است. ضایعات ممکن است چند کانونی یا تک کانونی باشند. ضایعات اغلب اطراف بطن هستند (60%) و بر ساختارهای عمقی مغز مانند corpus callosum، deep white matter یا basal ganglia تاثیر میگذارند. در سکانس T2، ضایعات به شکل iso یا hyperintense دیده میشوند. در این سکانس معمولاً ضایعات به شکل homogeneously enhancing و associated diffusion restriction دیده میشود. PCNSL نسبت به اندازه خود با مقدار خفیفی ادم تظاهر میکنند. در بیمارانی که قادر به تحمل اسکن MRI نیستند، یک CT با و بدون ماده حاجب ممکن است انجام شود.
برای ایجاد تشخیص قطعی PCNSL، نمونه بافت مورد نیاز است. این امر نیاز به بیوپسی از مغز دارد، اما معاینه CSF یا vitrectomy ممکن است تشخیصی باشد. تا 20 درصد از بیماران مبتلا به PCNSL ممکن است در هنگام تشخیص درگیری leptomeningeal داشته باشند. به این ترتیب، برای staging کامل، lumbar puncture مورد نیاز است. CSF باید از نظر basic cell count with differential، سطح گلوکز، سطح پروتئین، سیتولوژی و فلوسیتومتری ارزیابی شود. در صورتی که تست Immunoglobulin heavy chain gene rearrangement در دسترس باشد، میتوان آن را بر روی مایعCSF انجام داد. نتایج ممکن است از یافته های سیتولوژی و فلوسیتومتری پشتیبانی کند. ارزیابی بیمار با اسلیت لامپ برای جستجوی سلول های بدخیم در زجاجیه یا شبکیه چشم برای تکمیل staging ضروری است. در صورتی که با کمک روشهایی که ذکر شد بتوان بیماری فرد را تشخیص داد، ممکن است به طور بالقوه نیاز به بیوپسی مغز برطرف شود. با این حال انجام بیوپسی مغز نباید تا رسیدن جواب سایر آزمایشات به تعویق بیفتد زیرا علائم PCNSL ممکن است به سرعت پیشرفت کند و در صورت تاخیر در درمان منجر به وخامت حال بیمار شود. هنگامی که تشخیص بیماری فرد PCNSL در نظر گرفته میشود، مهم است که تجویز کورتیکواستروئید را تا پس از تایید پاتولوژیک به تعویق بیندازید.
درمان
درمان PCNSL باید به محض تایید تشخیص شروع شود. درمان این بیماری معمولاً در 2 مرحله انجام می شود: القاء (induction) و تثبیت (consolidation). هدف از induction القای یک پاسخ جزئی یا در حالت ایدهآل کامل است، در حالی که consodilation باقیماندههای بیماری را از بین میبرد و به حفظ بهبودی کمک میکند. تعداد کمی کارآزمایی بالینی تصادفی برای درمان PCNSL وجود دارد. به این ترتیب، هیچ استاندارد مورد توافق بر سر راهبرد induction یا consolidation وجود ندارد. با این حال، به طور کلی پذیرفته شده است که شیمی درمانی مبتنی بر MTX استاندارد مراقبت برای induction است. دوز MTX و درمان های همزمان تجویز شده ممکن است بر اساس ترجیحات منطقه ای و سازمانی متفاوت باشد. استراتژی های consolidation نیز متنوع است و اغلب برای هر بیمار به طور خاص طراحی می شود. استراتژیهای consolidation می توانند از شیمی درمانی myeloablative همراه با autologous stem cell transplant (ASCT) تا شیمی درمانی nonmyeloablative با دوز بالا، پرتو درمانی، نگهداری پزشکی (medical maintenance) یا حتی observation را شامل شوند.
از نظر تاریخی
، بیماران مبتلا به PCNSL با پرتو درمانی درمان میشدند. اگرچه تشعشع تمایل به ایجاد پاسخ های تصویربرداری چشمگیر دارد، تابش کانونی منجر به نرخ بالای عود در خارج از میدان تابش می شود. پرتودرمانی کل مغز (WBRT) نرخ پاسخ کلی 90% (ORR) را به همراه دارد. با این حال، پاسخ ها با دوام نیستند، تنها 12 تا 18 ماه پایدار هستند.
مقالات مرتبط
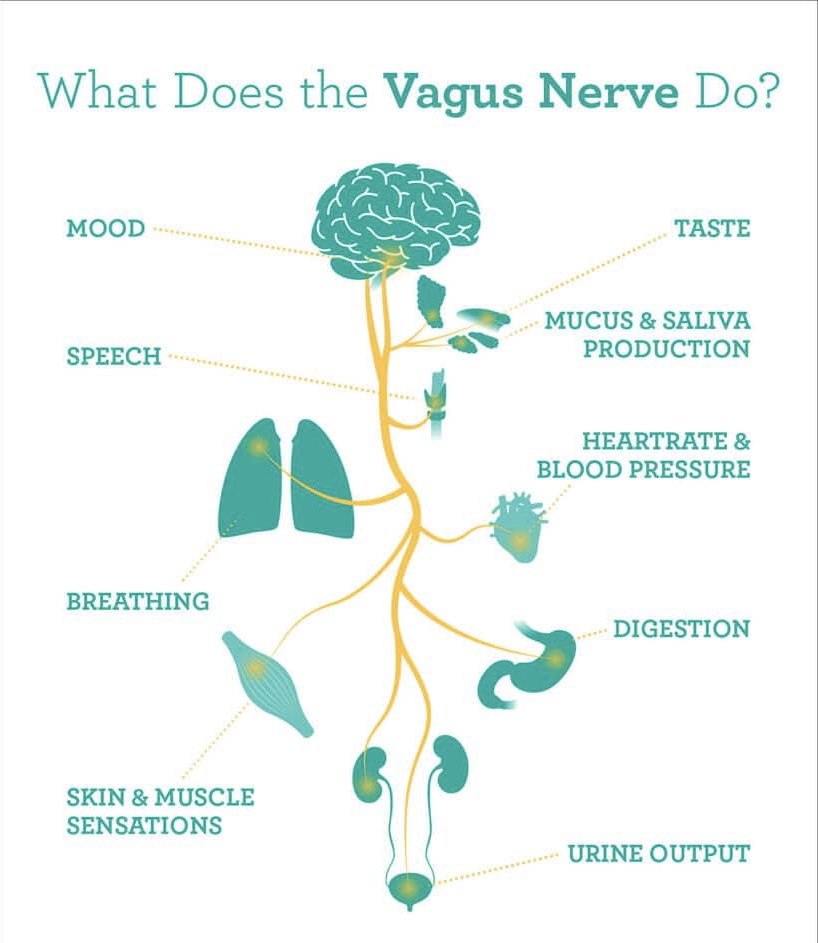
عصب واگ چیست؟ Vagus Nerve
عصب واگ، عصب زوج ۱۰ مغزی است که از ساقه ی مغز، بخش مدولا منشا میگیرد…
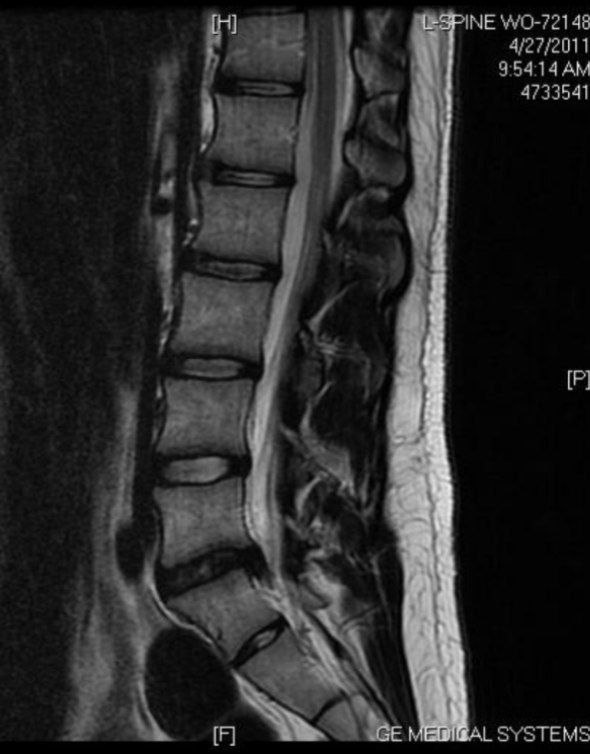
فتق دیسک بین مهره ای
فتق دیسک بینمهرهای ( Intervertebral Disc Herniation) عارضهای است که به علت ضربه یا بلندکردن جسم سنگین یا گاهی خود به خود در ستون فقرات اتفاق میافتد و طی آن آزاد شدن بخش مرکزی دیسک یا هسته دیسک (نوکلئوس پالپوزوس) از قسمت محیطی آن یعنی آنولوس فیبروزوس باعث فشار بر روی ریشههای عصبی و ایجاد علائم بالینی میگردد