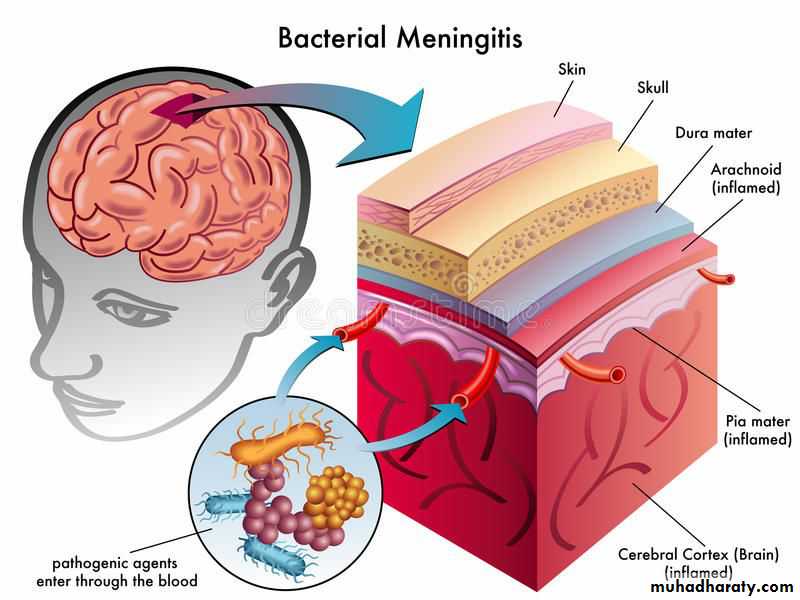
مننژیت در افراد جوان
خلاصه مقاله
رنج محدود پاتوژن ها ( Limited Pathogen Range) : با وجود طیف وسیعی از میکروب های بیماری زا انسانی، یک گروه منتخب شامل استرپتوکوک گروه B، E. coli، لیستریا مونوسیتوژنز، هموفیلوس آنفولانزا نوع b(Hib)، استرپتوکوک پنومونیه، و نایسریا مننژیتیدیس مسئول اکثر موارد بیماری هستند.
#بخش_اول
#مقاله_کیس
#مننژیت_در_افراد_جوان
#Management_of_meningitis_in_young_persons
🔵اپیدمیولوژی
🔰رنج محدود پاتوژن ها ( Limited Pathogen Range) : با وجود طیف وسیعی از میکروب های بیماری زا انسانی، یک گروه منتخب شامل استرپتوکوک گروه B، E. coli، لیستریا مونوسیتوژنز، هموفیلوس آنفولانزا نوع b(Hib)، استرپتوکوک پنومونیه، و نایسریا مننژیتیدیس مسئول اکثر موارد بیماری هستند.
🔰کمبود آنتی بادی به عنوان یک عامل خطر: فقدان آنتی بادی های اپسونیک یا باکتری کش که باکتری ها را هدف قرار داده و از بین می برند، عامل خطر اصلی مننژیت ناشی از پاتوژن های فوق الذکر است. مطالعات رابطه معکوس بین بروز مخصوص به سن Hib و Neisseria meningitidis و وجود فعالیت باکتری کشی سرم (serum bactericidal activity) را نشان داده اند. به طور مشابه، کمبود آنتی بادی های نوع خاص (type-specific antibodies) به طور قابل توجهی خطر ابتلا به مننژیت استرپتوکوکی گروه B در نوزادان را افزایش می دهد.
🔰تأثیر واکسیناسیون: شناسایی اهداف میکروبی که آنتیبادیهای اپسونیک/باکتریکش را ایجاد میکنند و توسعه برنامههای واکسیناسیون موفق با هدف قرار دادن این آنتیژنها در نوزادان و کودکان، اپیدمیولوژی مننژیت باکتریایی را بهطور قابلتوجهی تغییر داده است. واکسنهای Protein-conjugated capsular polysaccharide ، مننژیت ناشی از سروتیپهای مورد هدف را تقریباً ریشهکن میکنند.
🔰محدودیت های ایمنی گله و واکسن: ایمن سازی معمول دوران کودکی با واکسن های Hib conjugate عملا مننژیت Hib را در بسیاری از کشورهای پردرآمد از بین برده است. با این حال، محدودیت هایی وجود دارد. معرفی واکسن کونژوگه پنوموکوکی هفت ظرفیتی (PCV7) به طور قابل ملاحظه ای مننژیت پنوموکوکی را کاهش داده است، اما افزایش مننژیت سروتیپ غیرPCV7 (به عنوان مثال، سروتیپ19 A ) و کاهش بالقوه در سطوح بالای آنتی بادی ضد باکتریایی meningococcal نیاز به توسعه مداوم واکسن را افزایش داده است.
🔵یافته های بالینی
🔰ویژگی های بالینی متغیر: تشخیص مننژیت باکتریایی نیاز به اقدام سریع دارد، اما علائم بسته به سن، مدت زمان بیماری و پاسخ ایمنی کودک به طور قابل توجهی متفاوت است.
🔰علائم در نوزادان: نوزادان اغلب با علائم غیر اختصاصی مانند تب، بیحالی، تغذیه نامناسب یا برآمدگی فونتانلها ظاهر میشوند که تشخیص را دشوار میکند.
🔰علائم کلاسیک در کودکان بزرگتر: کودکان بزرگتر ممکن است علائم آشکارتری مانند تب، سردرد، سفتی گردن (تحریک مننژ)، حالت تهوع و گیجی را نشان دهند.
🔰حساسیت محدود علائم مرتبط با درگیری مننژ: در حالی که در 75 درصد از کودکان مبتلا به مننژیت باکتریایی علائم مرتبط با درگیری مننژ وجود دارد، عدم وجود تحریک مننژ، به ویژه در نوزادان زیر 12 ماه، بیماری را رد نمی کند.
🔰علائم دیررس: سه علامت فشار خون بالا، ضربان قلب آهسته و تنفس کم عمق (تریاد کوشینگ) نشان دهنده فشار شدید داخل جمجمه ای است که یک علامت دیرهنگام و نگران کننده است.
🔵یافته های آزمایشگاهی
🔰پانکسیون کمری: پس از رد کردن ضایعه توده ای از نظر بالینی یا با سی تی اسکن سر، پانکسیون کمری در جهت جمع آوری CSF برای تشخیص ضروری است.
🔰رنگ آمیزی گرم: رنگ آمیزی گرم CSF باعث تشخیص سریع باکتری ها می شود (رنگ آمیزی مثبت نشان دهنده تعداد باکتری بیشتر از 10^3 سلول در میلی لیتر است). دقت این روش رنگ آمیزی بر اساس پاتوژن متفاوت است: برای پنوموکوک و مننگوکوک دقت این روش بالا است، برای باسیل های گرم منفی متوسط و برای لیستریا دقت این روش پایین است. سانتریفیوژ Cytospin می تواند حساسیت رنگ آمیزی گرم را بهبود بخشد.
🔰پارامترهای CSF : تعداد و تفاوت سلول های CSF، همراه با غلظت پروتئین و گلوکز، به تمایز اشکال مختلف مننژیت کمک می کند . تعداد کم گلبول های سفید با رنگ گرم مثبت نشان دهنده پتانسیل پیامدهای ضعیف (poor outcomes) است.
🔰تأثیر آنتی بیوتیک ها: مصرف قبلی آنتی بیوتیک می تواند منجر به کشت منفی CSF شود. در چنین مواردی، افزایش تعداد گلبول های سفید و سطح پروتئین همچنان می تواند از تشخیص مننژیت باکتریایی حمایت کند. روشهای جایگزین مانند کشت خون یا آزمایشهای تشخیصی none-culture ممکن است برای شناسایی پاتوژن خاص ضروری باشد.
🔵رژیم ضد میکروبی تجربی بر اساس گروه سنی:
🔰کمتر از 1 ماه:
آمپی سیلین (50-100 میلی گرم بر کیلوگرم هر 6 ساعت) + جنتامایسین (2.5 میلی گرم بر کیلوگرم هر 8 ساعت)
یا سفوتاکسیم (50 میلی گرم بر کیلوگرم هر 6-8 ساعت)
#بخش_دوم
🔰 یک تا سه ماهگی :
آمپی سیلین (50-100 میلی گرم بر کیلوگرم هر 6 ساعت) + سفوتاکسیم (75 میلی گرم بر کیلوگرم هر 6-8 ساعت) یا سفتریاکسون (50 میلی گرم بر کیلوگرم هر 12 ساعت)
یا وانکومایسین (15 میلی گرم بر کیلوگرم هر 6 ساعت) می تواند برای مننژیت پنوموکوکی مشکوک اضافه شود.
🔰۳ ماه تا ۲۱ سال:
سفوتاکسیم (75 میلی گرم بر کیلوگرم هر 6-8 ساعت، حداکثر 12 گرم در روز) یا سفتریاکسون (50 میلی گرم بر کیلوگرم هر 12 ساعت، حداکثر 4 گرم در روز) + وانکومایسین (15 میلی گرم بر کیلوگرم هر 6 ساعت، حداکثر 1 گرم در هر دوز)
یا ریفامپیسین (10 میلی گرم بر کیلوگرم هر 12 ساعت، حداکثر 600 میلی گرم در روز) را می توان در کنار دگزامتازون اضافه کرد.
🔺منبع
📝ارائه دهنده: دکتر محمدسینا میرجانی
📝ادیتور: دکتر مهدی مهماندوست
✨شکوه دنیای اعصاب در انجمن علمی دانشجویی جراحی اعصاب
با ما همراه باشید.✨
🆔English:@NeurosurgeryAssociation
🆔Persian:@Neurosurgery_Association
مقالات مرتبط
خون ریزی ساب آراکنوئید
خونریزی ساب آراکنویید Subarachnoid Hemorrhage در ابتدا به شناخت تعریف و چگونگی بروز آن می پردازیم که به معنای خون ریزی در فضای ساب آراکنویید است
ساب دورال هماتوما
پاتولوژی رایج در جراحی مغز و اعصاب است که اغلب با عوارض و مرگ و میر قابل توجهی همراه است و گاهی اوقات برای تخلیه نیاز به عمل جراحی دارد.و از علایم ان می توان به ،افت فشار خون داخل جمجمه، آتروفی مغزی، یا ناهنجاری عروق مغزی پاره شده (آنوریسم، ناهنجاری شریانی وریدی،) اشاره کرد